Folding@Home har växt till världens största nätverk av datorer för distribuerad datahantering.Vi har stöttat projektet länge och som i en del i det har vi sammanställt den här artikeln som berättar lite om Folding@Home och sjukdomarna som man försöker lära sig mer om.
Folding@Home har fått en del utrymme bland nyheterna under det senaste året, även om vi följt projektet längre än så. Det var ingen slump att vi valde att offentliggöra NordicHardware Folding@Home, den första oktober förra året. Det hela startade faktiskt på just den dagen för åtta år sedan, den första oktober 2000, när Professor Vijay Pande vid Stanford University offentliggjorde Folding@Home. Hans mål var att komma åt de oändligt stora resurser som fanns vilande hos datorer runt om i världen, till ingen nytta, och använda det för att bättre kunna förstå hur proteiner veckar sig, varför de veckar sig fel och sjukdomar som beror av det.

Den nya logotypen som lanserades för ett tag sedan
Projektet drivs idag av The Pande Group vid Stanford University som leds av Professor Pande och har växt till världens största nätverk av datorer för distribuerad databehandling enligt Guinness (2007). I skrivande stund har den information som projektet samlat in bidragit till 69 samlade artiklar, varav den senaste handlar om influensahemagglutinin, något som är högaktuellt idag med svininfluensen som sprider sig.
I den här artikeln tänkte vi gå närmare ett par av de olika specifika sjukdomar som felvecka proteiner kan orsaka. Vi har valt att hålla en relativt enkel nivå på det hela för att så många som möjligt ska kunna hänga med, men om ni har vidare frågor så ska jag så klart försöka svara på dom med.
Vi börjar dock med att titta lite på Folding@Home i sig.
Folding@Home bygger inte på verkliga observationer utan på simuleringar av proteiner. Det är mycket viktigt att poängtera detta. Det vi ser är alltså inte verkligheten utan en möjlig verklighet. Genom kraftfulla matematiska formler och datorer spridda runt hela världen beräknar Folding@Home hur proteinerna högst troligen veckar sig och beter sig i sin naturliga miljö. Man vet vilka aminosyror proteinet består av, i vilken ordning de kommer och utifrån från det beräknar hur proteinet kan se ut.
Ibland vet man inte ens hur ett protein ser ut i sin naturliga miljö, utan istället utgår man från den gen som proteinet kommer ifrån och försöker räkna ut hur proteinet borde se ut. Det introducerar så klart en större osäkerhet, men det är ofta accepterat. I många fall har man dock lyckats hitta proteinet och isolerat det. Sedan har man lyckats ta en bild av det genom avancerade tekniker, till exempel med elektronmikroskop. Då vet man ganska säkert hur proteinet ser ut. Chansen finns ju fortfarande att det förändrats under isoleringen eller kanske att en del av det har ramlat av.
Första elektronmikroskopet med högre upplösning än ljusmikroskop. GNU 1.2
Folding@Home använder sig av en rad olika program utvecklade för molekylsimuleringar (t.ex. TINKER, GROMACS, AMBER, CPMD och SHARPEN), med prestandaoptimeringar. Dessa betecknas av Folding-klienten som Core med två efterföljande siffror. Till exempel Core 82 är baserad på AMBER, som är en av de två nu aktiva programmen. Det andra är GROMACS som är basen för hela 13 aktiva Cores, Inklusive båda GPU-klienterna och PlayStation 3-klienten.
Genom att beräkna hur ett protein veckar sig kan vi lära oss hur proteinet fungerar, vilka delar av det som har funktioner, ett protein har ofta mer än en funktion, och från det kan vi sedan försöka förstå sjukdomen som det orsakar och i bästa fall en behandling eller i alla fall lindring av symptomen.
Professor Pande berättar om The Pande Group
Stanford valde dessutom att introducera ett slags belöningssystem för att sporra de som deltar. Personer som bidrar kan nämligen ange ett användarnamn och ett lag-id när han eller hon installerar programmet. Det går givetvis att ändra i efterhand om man vill det. Alla poäng som skickas in med den klienten samlas på det namnet och till det laget. Alla kan sedan gå in på Stanfords hemsida för Folding@Home och se hur mycket man bidrar med i relation till alla andra.
De första Folding@Home-klienterna använde sig enbart av våra vilande processorer, men den andra oktober 2006 släppte Stanford University den första GPU-klienten. Det var för ATIs Radeon X1900 serie och efter några dagar beräknade man att dessa var ungefär 70 gånger snabbare än dåtidens genomsnittliga processor. Efter denna succé har utvecklingen fortsatt. Även om skillnaden, rent procentuellt, faktiskt är mindre idag än då, är GPU-klienten fortfarande mycket kraftfullare för enskilda individer. Idag stöds även NVIDIAs grafikkretsar.
Innan vi börjar med att kasta oss in på de olika sjukdomarna kan det vara bra med en snabb genomgång av vad protein är, hur de kommer till och var felen kan uppstå. Det ska sägas att ett felveckat protein leder ofta till att proteinet binder ihop med andra protein och det bildas stora klumpar med många olika proteiner inuti en cell som till slut inte kan överleva på grund av att den stora klumpen av protein är i vägen. Proteinerna i sig kan också ha viktiga funktioner för cellen och i andra fall när det inte klumpar ihop sig så bryter cellen istället ner det felaktiga proteinet, vilket då också gör att viktiga funktioner försvinner.
Som ni alla med största säkerhet vet består vi av celler. Det finns många olika typer av celler specialiserade på olika områden. Till exempel celler i muskler och i fett beter sig olika och har olika egenskaper, medan nervceller och hudceller har andra individuella egenskaper som gör det som de är bäst anpassade för. Varje organ består i sin tur av gängse celler som fungerar bäst i och runt just det organet. Det betyder också att vissa typer av fel är många gånger vanligare i vissa typer av celler än i andra. Det innebär också att om samma protein blir felveckat i en cell betyder det inte att får samma konsekvens om det sker i en annan typ av cell. Samma fel kan alltså få olika konsekvenser beroende på vilken typ av cell det är fråga om. Det är tyvärr så komplicerat.
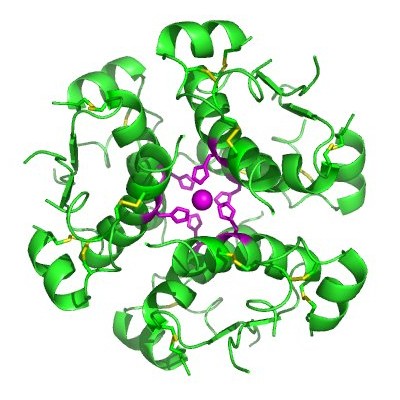
Insulinhexamer, insulin var det första protein man lyckades sekvensera. CC-BY 2.5
I varje cell med cellkärna finns en komplett dubbel uppsättning av vårt DNA, men DNA är inte bara en genetisk kod som vi för vidare till våra barn. Man uppskattar att det mänskliga genomet, vårt DNA, består av 25 000 eller mer gener(en siffra som ändrar sig hela tiden). Nästan varje gen fungerar som en mall och varje gen kan ge upphov till ett eller flera protein. En enda gen kan alltså innehålla information för mer än ett protein, vilket knappast gör det hela enklare på något sätt. Vi har uppemot 2 miljoner olika protein i kroppen.
Den absoluta majoriteten av all DNA är identisk mellan två slumpmässigt valda människor, men ytterst små skillnader kan leda till stora förändringar. Det flesta av alla protein arbetar i bakgrunden och gör bara sådant jobb som får cellen att gå runt och överleva. Om något av dessa går fel finns det ibland sätt att gå runt det, men ibland kör det ihop sig så rejält att cellen inte kan överleva och dör.
Sedan finns det de där få proteiner som märks mycket mer trots att de är mycket färre och kanske inte ens alltid finns i cellen. Många proteiner tillverkas nämligen endast när de verkligen behövs. Om de sen inte fungerar när cellen verkligen behöver dem förstår ni kanske att saker kommer att gå illa.
Men vi består ju av miljarder av celler, eller hur? Ja, men om felet uppstår i en cell finns det en överhängande risk att det kan uppstå även i nästa, och nästa, och nästa, och nästa, och … ja ni förstår. Om en cell slår fel på ett protein som leder till att cellen dör kan det finnas ett anlag i andra celler som ger samma resultat.
Huntingtons sjukdom orsakas av ett enda felaktigt protein som kallas Huntingtin, som man faktiskt inte vet vad det har för exakt funktion. Huntingston’s är en nervsjukdom som leder till försämrad koordination, ostadig gång (därav smeknamnet danssjukan) och viss nedsatt tankeförmåga. Den varierar mycket mellan individer och man kan ha olika kraftiga inslag av de tre mest framträdande symptomen nämnda ovan. Sjukdomen i sig dödar inte, men den anses förkorta livslängden ganska drastiskt för den det drabbar.
Tyvärr är det så att man inte känner till den exakta mekanismen för hur sjukdomen blommar ut. Det gör även att varje individ får en personlig behandling. Man försöker helt enkelt dämpa symptomen så mycket som det går för att göra livet så drägligt som möjligt under den tid som är kvar. Lite drygt 1 på 10 000 bär på anlag för sjukdomen, men det är inte jämnt fördelat över världen utan vissa områden är mycket hårdare drabbade än andra. Det är till exempel extremt mycket vanligare bland indianer i Sydamerika än hos människor i Norra Europa.

George Huntington, (9 April 1850 – 3 Mars 1916), var den första som beskrev sjukdomen
Sjukdom kan tyvärr träda in i vilken ålder som helst, men det är vanligast runt 40-årsåldern. Eftersom Huntingtons sjukdom orsakas av en enda felande gen, det är långt ifrån så enkelt i de flesta sjukdomar, kunde man ganska snabbt hitta ett sätt för diagnostisera sjukdomen. Det har även gjort att forskningen kring Huntingtons sjukdom har gått snabbt framåt, även om man ännu inte nått hela vägen än, långt ifrån. Eftersom den är klart ovanligare i västvärlden är det svårare att få bidrag än andra sjukdomar som drabbar just den rikare delen av världen.
Det hela grundar sig i att det finns ett område i genen för Huntingtin som leder till att en svans som består av många glutamin-aminosyror på rad bildas. Det är en polär oladdad aminosyra, vilket i normal mängd inte orsakar några problem. Ett friskt protein har en svans på uppemot 27 stycken glutamin på rad och har inga problem med det. Desto fler upprepningar man har utöver dessa 27 desto tidigare kommer sjukdomen att uppenbara sig och desto snabbare kommer den att utvecklas och orsaka problem. Den behöver dock inte bli alltför allvarlig för det, om man har tur.

Woodrow Wilson Guthrie, känd som Woody Guthrie, är en av de mer kända personer som avlidit från Huntingtons.
Han var en älskad folkmusiker och anses vara en förgrundsfigur bland amerikanska folkmusiker.
När svansen blir för lång, över 39 och längre kommer sjukdomen att blomma ut helt och leda till en klart försämrad livskvalité. I vissa fall, under 7% av fallen, är svansen på över hundra aminosyror och i dessa fall kommer sjukdomen att utvecklas snabbt och leda till en kraftig förkortning av livslängden. I dessa fall visar sig de första symptomen ofta innan personen hunnit fylla 20 år.
När svansen blir så lång gör det att proteinet inte kan vecka sig som det ska, det binder till andra protein i större mängd och gör att viktiga funktioner inuti cellen blockeras. Tyvärr vet man inte Huntingtins exakta funktion, vilket gör det svårt att förklara sjukdomens exakta detaljer . Den som vill veta mer kan vända sig till den svenska sidan www.huntington.nu för mer information.
Vi går vidare med galna kosjukan.
Creutzfeldt-Jakob sjukdom (CJS) är den mänskliga varianten av galna kosjukan som härjade ganska vilt i början av 2000-talet. Det är en extremt ovanlig sjukdom (1 på 1 miljon per år), men samtidigt omöjlig att bota eller ens möjlig att behandla till någon större grad. Symptomen är ofta minnessvårigheter, personlighetsändringar och hallucinationer. Sjukdomen klassas som en överföringsbar spongiform hjärnsjukdom. Spongiform innebär att hjärnan förvandlas till en svamplik massa.
CJS orsakas av felveckade prioner, en form av protein, som dessutom ofta är väldigt motståndskraftiga mot både värme och cellens egna nedbrytningssystem. Ofta hjälper det första prion-proteinet till att flera felveckade prioner kan bildas. Det blir alltså en ond cirkel där ett felveckat prion accelererar bildningen av nya, felaktiga prion. De kan sedan binda till varandra och bilda stora bollar med prion som blockerar funktioner och till slut dödar cellen. Idag finns det inget vi kan göra för att stoppa detta.
Prioner förekommer dock helt normalt hos alla människor och i rätt form har det en viktig funktion hos oss, tror man men exakt vad är lite osäkert. Man gissar att det binder till ytan av celler där det troligen hjälper till med signalering eller transport mellan celler. Men ibland går något snett och prionen vänds ut och in och stannar så. Det är då felveckat och accelererar sedan felveckningen av fler elaka prion.

TV-bilder rullade världen med skrämmande bilder på sjuka kor
Sjukdomen kan bero på att en mutation uppstår i den ansvariga genen, men det förekommer endast hos 5-10% av alla patienter. Det finns även tre varianter, familjär, sporadisk och “variant”, som yttrar sig lite olika och drabbar folk i olika åldrar, men orsaken är densamma; felveckade prion bildas som leder till mer prioner som leder till mer prioner. Sjukdomen kan därför överföras mellan individer eftersom proteinet är grunden i sjukdomen och oftast inte något direkt genetiskt fel.
Man kan alltså drabbas av CJS genom att äta kött från djur med samma sjukdom, men man har även studerat fall där sjukdomen spridit från en individ till en annan genom kannibalism. På senare tid har man även begränsat blod- och spermadonationer eftersom man misstänker att CJS kan smitta den vägen med. Framför allt det förstnämnda finns det starka indikationer för spridning.
Det finns ingen bekräftad behandling och dör i regel en högst otrevlig död inom 1-2 år efter diagnos ställts.
Alzheimers sjukdom är nog den sjukdom som kanske de flesta kommit kontakt med på ett eller annat sätt. Det är på inga vis en trevlig sjukdom eftersom den smyger sig på och sakta leder till en försämring. Alzheimers dödar och är obotligt. Det är vanligast hos människor över 65 år. Det finns väldigt många olika symptom och varje fall av Alzheimers är unikt. Vanligast är dock svårigheter med närminnet och inlärning.
Allteftersom sjukdomen blir värre blir patienten mer förvirrad, sinnen nedsätts, och den uppvisar känslosvängar där det inte är ovanligt med aggression och irritation. Sakta försämras även motorfunktionerna som till slut leder till döden, vilket tyvärr är väldigt svårt att förutse eftersom sjukdomen är så individuell. Medellivslängden är dock sju år efter ställd diagnos, men enskilda fall kan leva upp till det dubbla.
Man vet tyvärr lite om hur Alzheimers uppstår och utvecklas, men man har säkerställt att patienter som har diagnostiserats med Alzheimers har bildat två olika typer av proteinaggregat (klumpar) där den ena typen beror på att ett protein kallat tau blir hyperaktivt och börjar binda till andra tau-protein (dessa bollar kallas ”tangles”) inuti nervceller som leder till att cellens interna transportsystem bryts ner och inte längre kan skicka nervsignaler. Den andra sorten består av en del av proteinet amyloid, som tros vara giftigt för nervcellerna när det bildar dessa aggregat (dessa kallas plack).

2000 påstod forskare att strålning från mobiltelefoner kunde orsaka Alzheimers sjukdom,
det har varit ganska tyst om det sedan dess
Båda proteinerna är så klart felveckade, men hur felveckningen uppstår är oklart. I fallet med amyloid är det endast en del av proteinet amyloid, beta-amyloid, som bildar dessa aggregat. Av en okänd anledning så blir det hela amyloidproteinet sönderdelat och en av delarna som bildas är just beta-amyloid. Man vet inte säkert vilket av de två klumparna, ”tangles” eller plack, som verkligen orsakar sjukdomen. Olika läger stöttar endera teori, men båda typerna av klumpar förekommer hos alla patienter med Alzheimers.
Det betyder alltså att till skillnad från de andra sjukdomarna vi pratat om har man inte bara ett protein som felveckar sig och behöver studeras utan två utan att man vet vilket som verkligen är det som gör att sjukdomen blommar ut. Faktum är att träning, hjärngympa och en balanserad diet är det som brukar rekommenderas för personer som ligger i riskzonen eller befinner sig i ett tidigt skede av Alzheimers. Inget annat har visat sig vara effektivt bortom några placebotvivel.
Cystisk fibros är en väldigt hemsk sjukdom som leder till döden redan i unga år. Den drabbar många (1 på 4000 i USA, medan 1 på 20 i medelhavsområdet bär på genen) och är dessutom ärftlig. De första symptomen för cystisk fibros visar sig dessutom ofta vid väldigt unga år, man ser många gånger de första tecknen hos nyfödda. De som ligger i farozonen testas med ett enkelt gentest, men det måste kompletteras med ett svettest för att man ska vara säker på att sjukdomen är aktiv och personen inte bara en bärare av den dåliga genen utan att lida av den.
De vanligaste symptomen är en irriterad och inflammerad hals med ihållande hosta. Det beror många gånger på att slemmet i halsen blir för tjockt och att i sin tur bakterier, som finns där normalt och inte orsakar problem, växer till sig och orsakar inflammation. De flesta problemen med cystisk fibros yttrar sig också genom andningsproblem av olika slag efter att lungvägar ändras, syreupptagningen blir sämre och infektioner med andra utomstående bakterier och svampar.
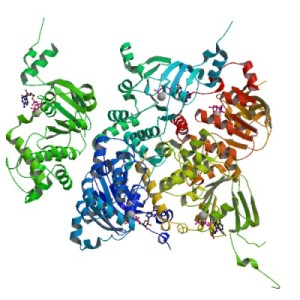
Cystic fibrosis transmembrane conductance regulator (, 1XMI, ett protein det kan bli många fel på.
Cystisk fibros kommer av att en person har två felaktiga gener för ett protein som kallas cystic fibrosis transmembrane conductance regulator (CFTCR). Alla gener finns i dubbel uppsättning och det räcker alltså att man har en fungerande gen för att man ska klara sig. CFTCR är ett protein som sitter i cellmembranet och pumpar kloridjoner (Cl–) över membranet. Det är väldigt viktigt för att kunna producera ett lättflytande slem på olika slemhinnor (lungorna bland annat) och vid svettproduktion.
Den trasiga genen kan ha många olika fel som leder till cystisk fibros men den vanligaste är att en liten bit har försvunnit, vilket gör att det saknas en aminosyra mitt i proteinet. Det leder till att proteinet helt enkelt inte kan vecka sig som det ska och sedan bryts ner av cellen. Andra vanliga fel är att inte hela proteinet produceras, utan bara en bit av det, eller att det innehåller mutationer som gör att det inte kan transportera kloridjonerna.
En person som drabbas av cystisk fibros kommer högst troligen inte att leva till den hinner fylla 40 år. Tyvärr krävs det en lungtransplantation för att man ska kunna överleva så länge och många dör redan efter knappt 20 år fyllda. Nya behandlingar har dock lett till att drabbade lever längre och längre.
Nu när vi gett en kort beskrivning av ett par av de sjukdomar som felveckade protein kan leda till och kort förklarat hur Folding@Home kan vi gå vidare till att diskutera hur man enklast bidrar till projektet. Det finns i grund och botten tre varianter av klienter: CPU, GPU (grafikkort) och PlayStation 3.
Den senare är en variant av CPU-klienten som är specialdesignad för Sonys spelkonsol PlayStation 3. Den finns att ladda ner för alla användare och ligger under Network i XMB (XrossMediaBar). Från och med den 18:e september 2008 döptes klienten om till “Life with PlayStation”. Den senaste versionen av Life with PlayStation innehåller ett Advanced Mode som stänger av alla andra funktioner som kan ta resurser ifrån Folding@Home-klienten och förbättrar därmed prestandan något.
Folding@Home med PlayStation 3
Det finns flera varianter av både CPU- och GPU-klienterna. De enklaste varianterna (“systray clients”) är … enklare och diskretare, men de ger också mindre poäng överlag. De ska dock inte förringas eftersom varje litet bidrag är värt mer än inget alls. De installeras lätt och behöver inte övervakas något efter att man gjort alla inställningar första gången. Poängen ramlar sakta men säkert in utan att man behöver göra någonting eller störas av något extra fönster någonstans. Det gäller både CPU- och GPU-klienterna.
GPU-klienterna installeras enklast på samma visa som de enkla CPU-klienterna som lägger sig i bakgrunden, med endast en liten ikon i “systray”. De producerar i regel klart mer poäng än CPU-klienterna och många väljer att köra enbart GPU-klienten istället eftersom att köra både och kan upplevas lite klumpigt.
Om ni vill ha hjälp med att komma igång eller har frågor om prestanda eller vilken klient som är rätt för dig kan du vända dig till vårt forum där du kommer få all hjälp du kan behöva. Klienterna laddar du ner från Stanford Universitys hemsida, länk finns nedan;
Det här var bara några av de många, många typer sjukdomar och tillstånd som orsakas felveckade proteiner. Många, många former av cancer kan orsakas direkt eller indirekt av felveckade proteiner och antalet mindre allvarliga och vanliga sjukdomar som orsakas av olika protein om veckas konstigt skulle ta många, många sidor att bara rabbla upp. Nu väljer man dock främst att försöka förstå, bland annat, de sjukdomar som finns nämnda här innan och inte alla sjukdomar på en gång.
Den mänskliga kroppen innehåller flera hundra tusen olika proteiner, över 40% av vår massa är protein. En normal kille bär alltså på runt 35kg protein. Även om många proteiner har viktiga funktioner för att flytta saker in och ut ur celler, signalera mellan celler, bryta ner molekyler eller katalysera reaktioner runtom i vår kropp, är det också protein som utgör själva skelettet i våra små celler. Om ett sådant protein skulle bli felveckat skulle cellerna tappa form och inte kunna fungera över huvud taget.
Det finns alltså all anledning i världen att försöka förstå varför proteiner veckar sig fel. Att protein veckar sig rätt utgör en sådan vital del för att vi över huvud taget ska kunna leva gör Folding@Home värd all möda i världen. Det förekommer ofta diskussioner kring huruvida det går att rättfärdiga projektet i och med den ökade elkonsumtionen som det leder till, men hur man än vrider och vänder på det faller valet till slut på den enskilde individen.
En hög elräkning är aldrig kul och de som aktivt väljer att inte bidra har givetvis all rätt att göra det. De utgör bara en liten del dock och de viktigaste är faktiskt alla människor som inte tagit ett beslut eller ens hört talas om Folding@Home. Det är snarare dessa människor man ska prata med och visa vad de kan göra för att vi ska förstå sjukdomarna bättre genom en, i all ärlighet, ytterst minimal ansträngning. En person som gjort ett aktivt val emot kommer högst troligen att kräva mycket mer tid och energi att konvertera, än en person som inte ens vet hur enkelt det är att bidra.
















